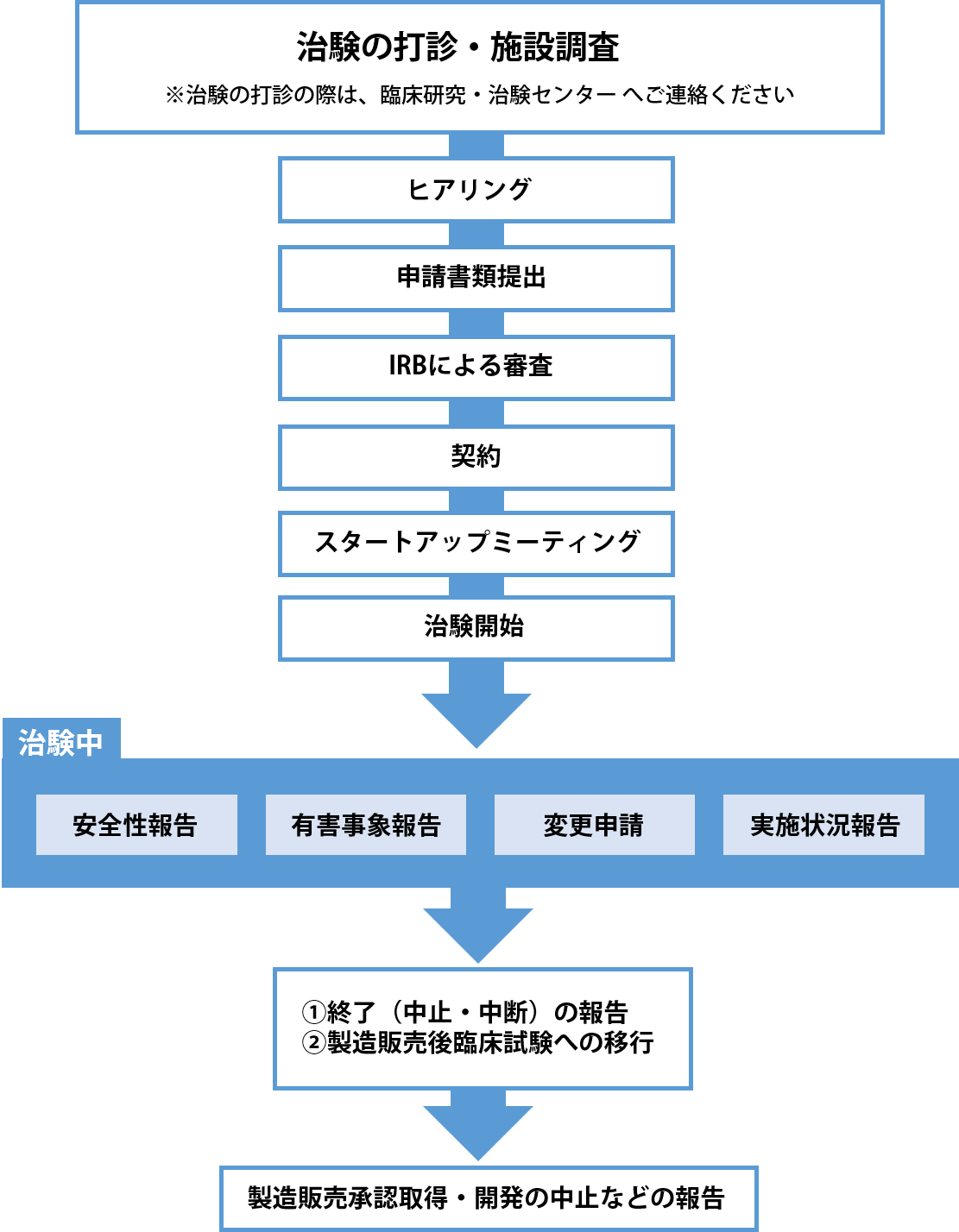
治験申請までの流れ
①初回申請書類
¹)項目:治験薬の説明、目的、これまでの試験成績の概要(有効性、安全性)、選択・除外基準、評価項目、スケジュール、検査。観察項目、併用禁止薬・制限薬、遺伝子解析を伴う場合は、その内容、その他必要な項目を記載
②IRB審査資料
| 必要書類 |
|---|
| ①治験依頼書(書式3) |
| ②治験実施計画書 ²) |
| ③治験薬概要書 ³) |
| ④同意説明文書 ⁴) |
| ⑤治験責任医師の履歴書(写)及び治験分担医師、治験協力者リスト(書式2)(写) |
| ⑥被験者の健康被害に対する補償に関する資料 ⁵) |
| ⑦被験者への支払いに関する資料 ⁶) |
| ⑧予定される治験費用に関する資料 ⁷) |
| ⑨被験者の安全に係る事項(必要時) |
| ⑩開発業務委託機関の業務範囲に関する資料 |
| ⑪治験審査委員会が必要と認める資料 |
¹)²)⁴)治験責任医師と治験依頼者が合意したもの
³)製造販売後臨床試験は添付文書とインタビューホームを提出
⁵)保険の概要
⁶)負担軽減費に関し説明した資料
⁷)保険外併用療養費の対象期間、費用負担などについて
③治験変更手続き
変更申請に必要な書類
| 必要書類 |
書式 |
| 治験に関する変更申請書 |
統一書式10(厚生労働省HPよりダウンロード)書式見本:記入上の注意 |
| 変更対比表 |
変更対比表 |
| 以下、変更があった書類、様式を変更申請書と共に提出してください |
| 研究計画書 |
2部(研究計画書に変更がある場合) |
| 説明文書及び同意書、同意撤回書 |
2部(説明同意文書に変更がある場合) |
| 履歴書 |
治験責任医師の変更がある場合 |
| 契約書 |
|
④治験安全性の申請手続き
安全性の申請手続きに必要な書類
| 必要書類 | 書式 |
|---|
| 安全性情報に関する報告書 | 統一書式16(厚生労働省HPよりダウンロード) |
| 有害事象報告一覧 | A:個別症例報告(日本製薬協協会個別症例一覧)
B:1年ごとの年次報告 |
⑤治験継続審査
治験開始から1年間経過ごとに提出してください
⑥重篤な有害事象/有害事象の報告
重篤な有害事象に関する報告書/有害事象に関する報告書:1部
重篤な有害事象に関する報告書/有害事象報告書(詳細記入様式)1部
⑦終了(中止)報告
⑧緊急回避報告
⑨製造販売承認取得・開発中止及び治験の中止・中断