血液がんについて
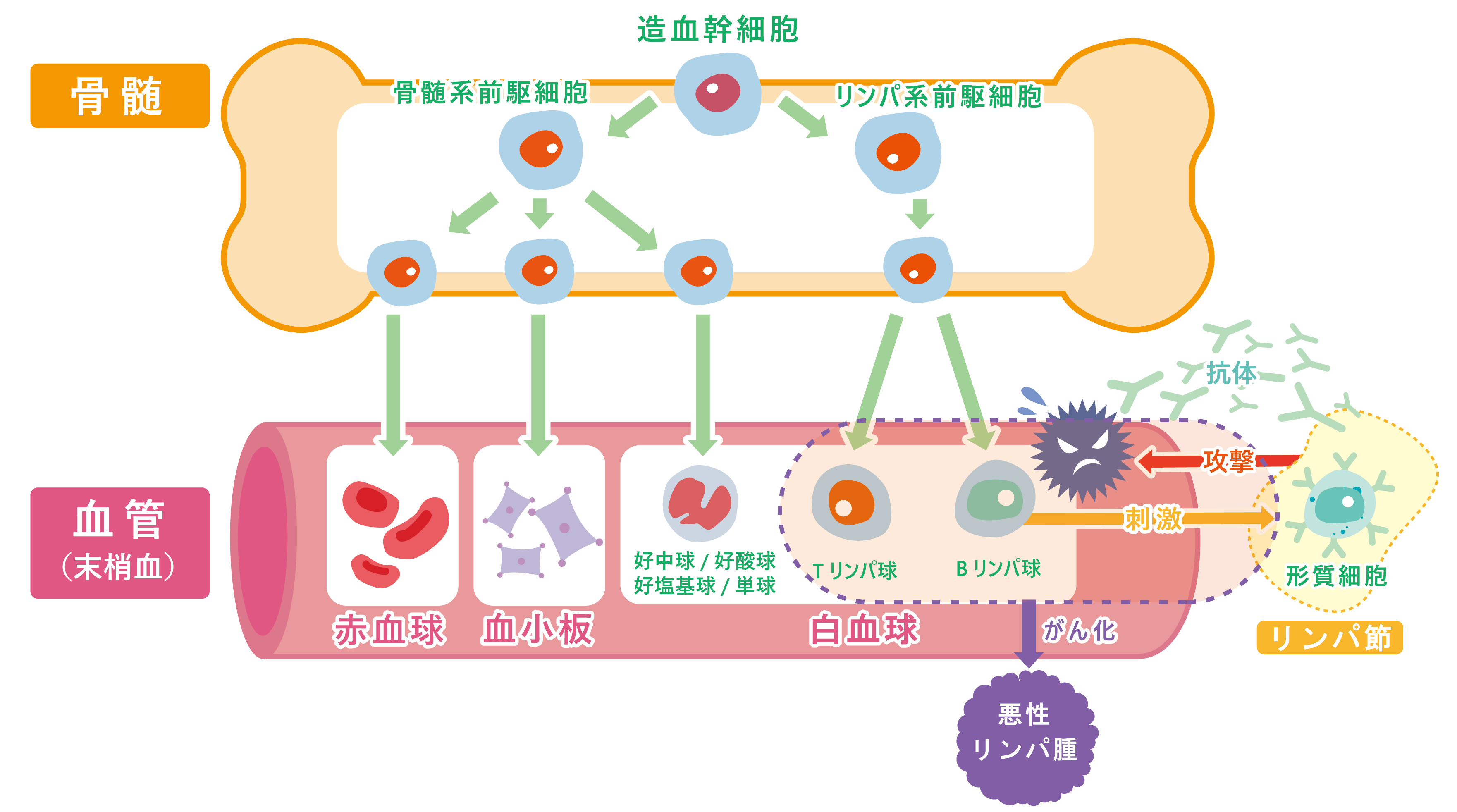
血液は、全身のすみずみに酸素を届ける「赤血球」、細菌やウイルス、がん細胞などの異物から体を守る免疫をつかさどる「白血球」、出血を止める「血小板」という3種類の「血液細胞」と、栄養の運搬や免疫などにかかわる「血漿(けっしょう)」という液体成分で構成されています。これら全ての血液細胞は、骨の中にある「骨髄」という組織で造られています。 骨髄中には、全ての血液細胞の基になる「造血幹細胞」があります。造血幹細胞は、骨髄の中で成長(分化)し、やがて一人前の機能を持った血液細胞に成熟した後、血液中に送り出されます。ところで、「白血球」という名前の血液細胞はありません。実は白血球とは、“好中球”・“好酸球”・“好塩基球”・“単球”・“リンパ球”など、それぞれ異なる働きを持った成熟した免疫細胞の総称なのです。
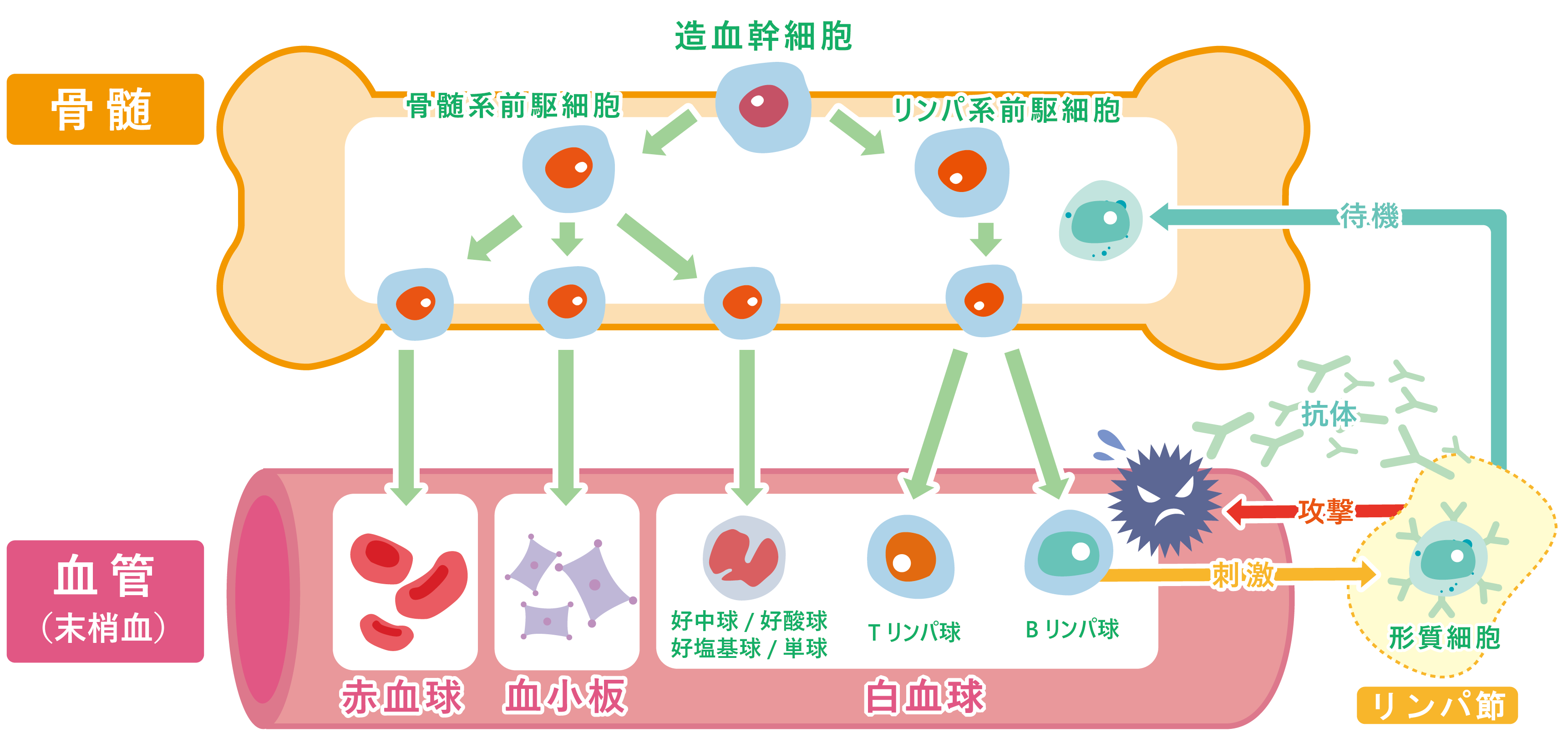
「血液がん」とは、骨髄中の未熟な血液細胞や成熟した免疫細胞が、「がん化」して起こる病気です。がん化とは、血液細胞が成長(分化)を止めて、本来の機能を失い、無限に増殖する状態をいいます。その種類は、がん化した血液細胞の種類やがん化の原因(多くは遺伝子異常)によって多岐にわたりますが、大きく分類すると「白血病」「悪性リンパ腫」「多発性骨髄腫」の3つに分けられます。また、これら血液がんに対する治療は、手術が中心となる他のがんとは異なり、薬による治療(薬物療法)が中心となります。
白血病について
白血病は、「急性白血病」と「慢性白血病」とに分けられますが、“いわゆる白血病”とは急性白血病を指すことが多いため、ここでは急性白血病について説明します。
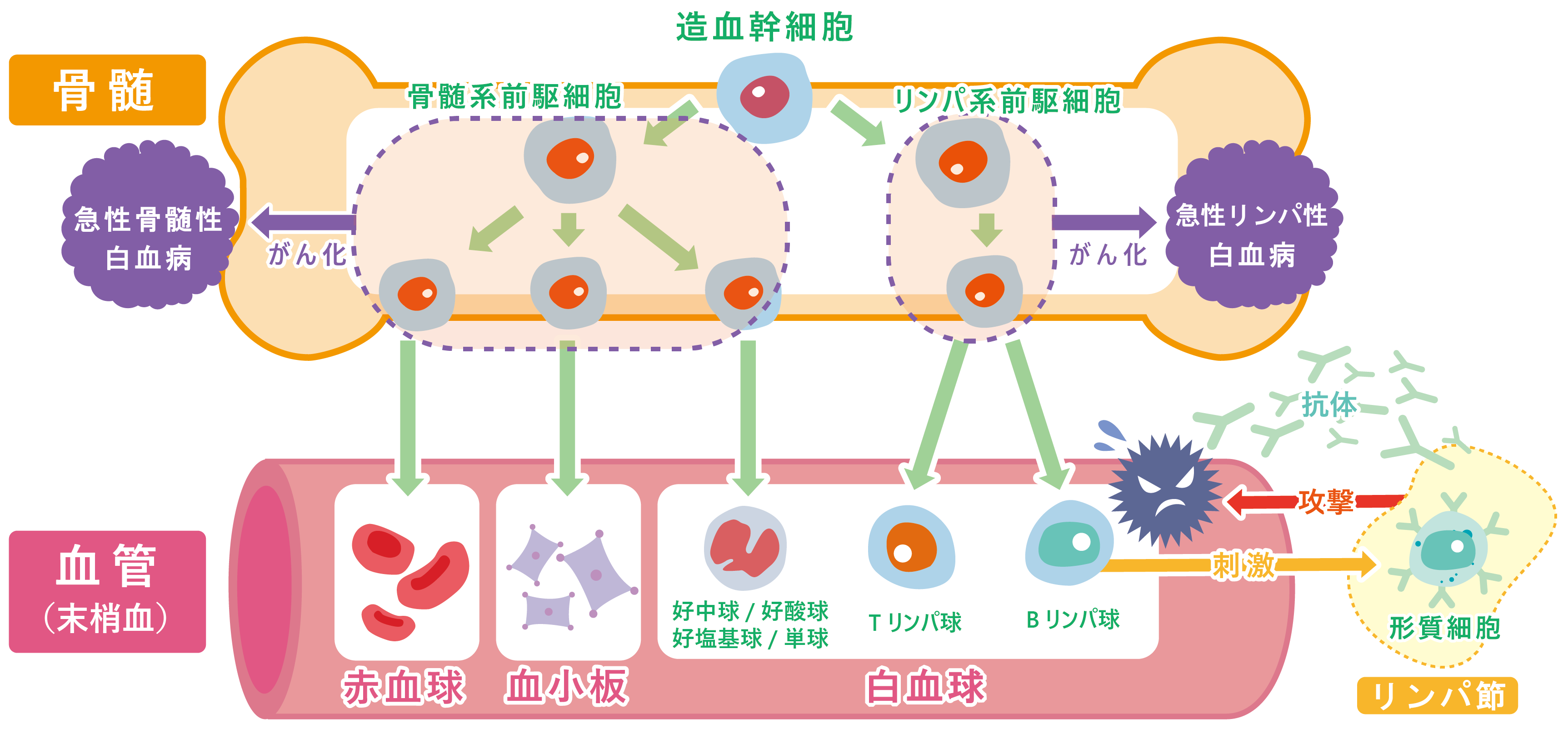
急性白血病とは、骨髄中の未熟な血液細胞ががん化し、正常な血液が造れなくなる病気です。「骨髄系前駆細胞」由来の未熟な血液細胞ががん化したものを「急性骨髄性白血病」と呼び、「リンパ系前駆細胞」由来の未熟な血液細胞ががん化したものを「急性リンパ性白血病」と呼んでいます。急性骨髄性白血病は比較的成人に多く、急性リンパ性白血病は小児に多く見られます。
白血病細胞の増殖スピードは非常に速く、無治療であれば数週間で命を落とす可能性があります。そのため、白血病と診断されれば、専門の施設で早期に治療を開始する必要があります。
急性白血病の症状
正常な血液細胞が減ってしまうことで、さまざまな症状が現れます。貧血による疲れやすさやめまい、動悸、息切れ、白血球の減少による感染に伴う発熱、血小板の減少による出血症状(歯肉出血・鼻出血・皮下出血など)などが見られます。また、白血病細胞は、体中の臓器にも広がっていくことがあります。そのため、脳などの中枢神経に広がれば意識障害やけいれんが、肝臓に広がれば黄疸や腹水が溜まるなどの症状が見られます。
急性白血病の種類
以前は顕微鏡での観察による白血病細胞の顔つき(形態)によってのみ、白血病は分類されていました(FAB分類)。最近では、形態のみならず、染色体・遺伝子異常の種類や発病までのがんの治療歴の有無などによって分類されたWHO分類を用いて、白血病の診断が行われています。これにより現在、50種類以上の白血病に分類されています。「たちの良い(予後良好)」白血病から「たちの悪い(予後不良)」白血病までさまざまなものがありますが、“たち”を決める重要な要素は、「発病年齢」と「染色体・遺伝子異常」の種類です。
急性白血病の検査
白血病の診断やたちの良さ・悪さを判断するため、血液検査や「骨髄検査」などが行われます。骨髄検査では、骨髄から骨髄液や骨髄組織が採取され、白血病細胞の数や形態に加え、白血病細胞の染色体・遺伝子異常なども調べられ、どの種類の白血病であるか、またどの程度たちが悪いのかが診断されます。通常うつぶせになって、左右どちらかの骨盤の骨の突起部分に少し太めの針を刺して行われます。局所麻酔薬を注射してから行われますので、それ程強い痛みを感じることはありません(ただし、骨髄血採取の瞬間に多少の痛みを感じることがあります)。また、脳や脊髄に広がっていると疑われる場合には髄液検査も行われます。
急性白血病治療の概要
白血病の種類や染色体・遺伝子異常の有無、患者さんの年齢や体の状態によっても、治療目標は異なります。70才までの患者さんでは、おおむね根治を目指した治療が選択されます。一方、70才を越えた患者さんでは、症状を和らげながら少しでも長生きに繋がるような治療が選択されます。根治を目指す場合、体の中の白血病細胞が“0”になるように(Total cell kill)、強力な「薬物療法(抗がん薬治療)」が行われます。使用される抗がん薬は白血病の種類によって異なりますが、通常いずれの白血病に対しても、複数の抗がん薬を併用した「寛解導入療法」と「寛解後療法(地固め療法、維持・強化療法)」とが行われます。 寛解導入療法とは、体の中からほとんど白血病細胞がなくなり、かつ正常な血液細胞が回復した状態を目指す治療です。仮にこの状態が得られたとしても、体の中には109個(10億個)の白血病細胞が残っていると考えられています。少しでも白血病細胞が残っていれば簡単に再発してしまいますので、白血病細胞を限りなく0に近づけるよう、その後繰り返し寛解後療法が行われます。
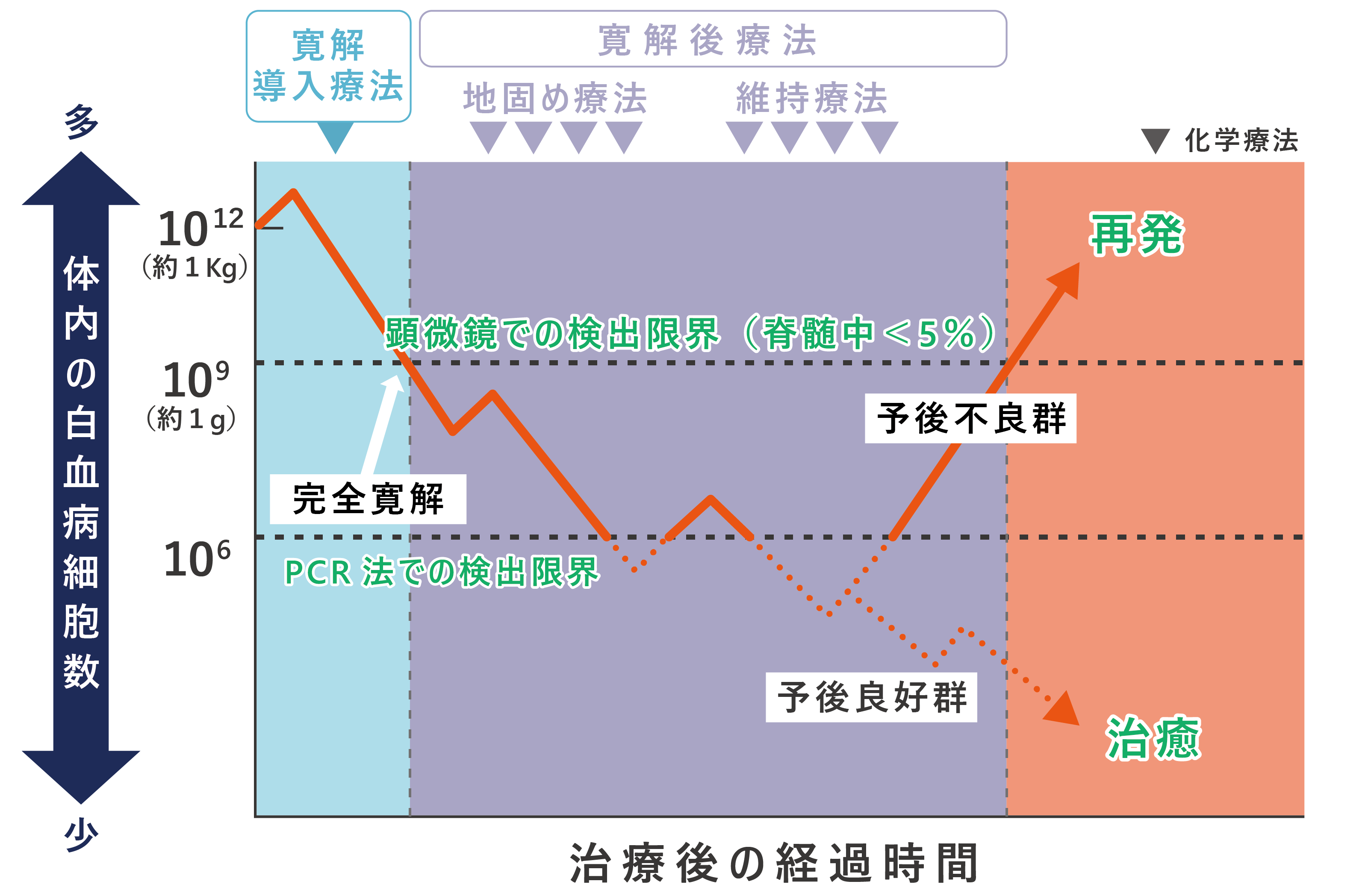
ただし、“たちの悪い(予後不良)”白血病では、寛解後療法をいくら行っても白血病細胞が0になることはありません。そこで、たちの悪い白血病患者さんに対しては、「造血幹細胞移植」を行い、根治を目指します。造血幹細胞移植では、移植の前に強力な薬物療法や放射線治療を行い、体の中に残る白血病細胞を出来るだけ死滅させたあと、正常な造血幹細胞を移植して造血機能を回復させます。患者さん自身の造血幹細胞を用いる場合には「自家移植」、健康な他人(ドナー)の造血幹細胞を用いる場合には「同種移植」と呼んでいますが、通常白血病では同種移植が行われます。
白血病細胞の表面に存在する特定の抗原(蛋白質)を狙い撃ちにする薬剤(抗体薬物複合体薬:ゲムツズマブオゾガマイシン、イノツズマブオゾガマイシンなど)や、遺伝子異常や増殖・生存に関係する分子機構を狙い撃ちにする薬剤(ダサチニブ、ギルテリチニブ、ベネトクラクスなど)を用いた、「分子標的療法」も行われています。急性骨髄性白血病の一つである「急性前骨髄球性白血病」に対しては、ビタミンAの仲間であるレチノイン酸(ATRA)を用いて、未熟な白血病の成長を促し、やがて寿命を迎えさせる、「分化誘導療法」が行われています。これらの分子標的療法は、単独でも行われますが、薬物療法との併用で高い治療効果を発揮します。最近では、白血病に対する新しい治療薬の開発は、分子標的薬が中心となっています。
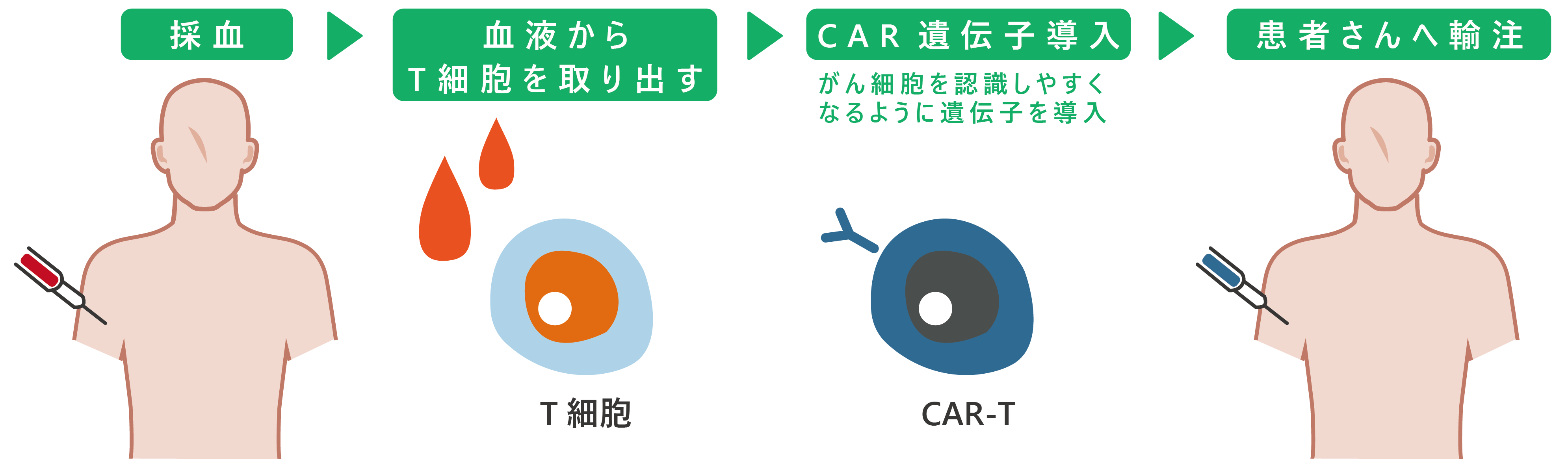
また通常の治療では十分な効果が得られない患者さんに対して、白血病細胞に対するTリンパ球の免疫反応を強化した、「免疫療法」が行われています。ブリナツモマブは、がん化したBリンパ球(B細胞性白血病細胞)と患者さんの正常なTリンパ球とを繋ぎ合わせる抗体(「二重特異性抗体」)で、Tリンパ球が白血病細胞を攻撃しやすくします。年齢を問わず、B細胞性急性リンパ性白血病の患者さんに行われています。「CAR-T療法」は、患者さんの体から正常なTリンパ球を取り出し、がん化したBリンパ球(CD19陽性B細胞性白血病細胞)を攻撃しやすくする遺伝子を導入して再び患者さんの体に返し、遺伝子導入Tリンパ球(CAR-T細胞)が白血病細胞を攻撃し死滅させることを期待する治療です。25才以下のCD19陽性B細胞性急性リンパ性白血病の患者さんに対して行われています。
悪性リンパ腫について
骨髄中で成長・成熟したリンパ球は、血管やリンパ管を通って、リンパ節や免疫を担う臓器(胸腺・脾臓・扁桃など)にたどり着きます。ここで細菌やウイルス、がん細胞などの異物の刺激を受けながら、刺激を受けた異物に対してより的確に働く免疫細胞へと成長していきます。「悪性リンパ腫」とは、骨髄中で一旦成熟したリンパ球が、異物の刺激を受けながらさらに高度な機能を持った免疫細胞へと成長していく途中でがん化した病気です。がん化したリンパ球は、リンパ節などで異常に増殖するため、リンパ節の腫れなどの症状が出現します。
悪性リンパ腫の症状
悪性リンパ腫の種類や増殖する場所によっても異なりますが、通常、首や脇の下、足の付け根などのリンパ節が腫れ、痛みのないしこりを触れるようになります。また進行すると、発熱や全身の倦怠感、体重減少、寝汗などさまざまな症状(B症状と言われています)が現れます。悪性リンパ腫による塊(腫瘤)が大きくなれば、気道や血管、脊髄などの臓器を圧迫し、気道閉塞、血流障害、麻痺など命にかかわる症状が現れることもあり、緊急で治療が必要となる場合があります。
悪性リンパ腫の種類
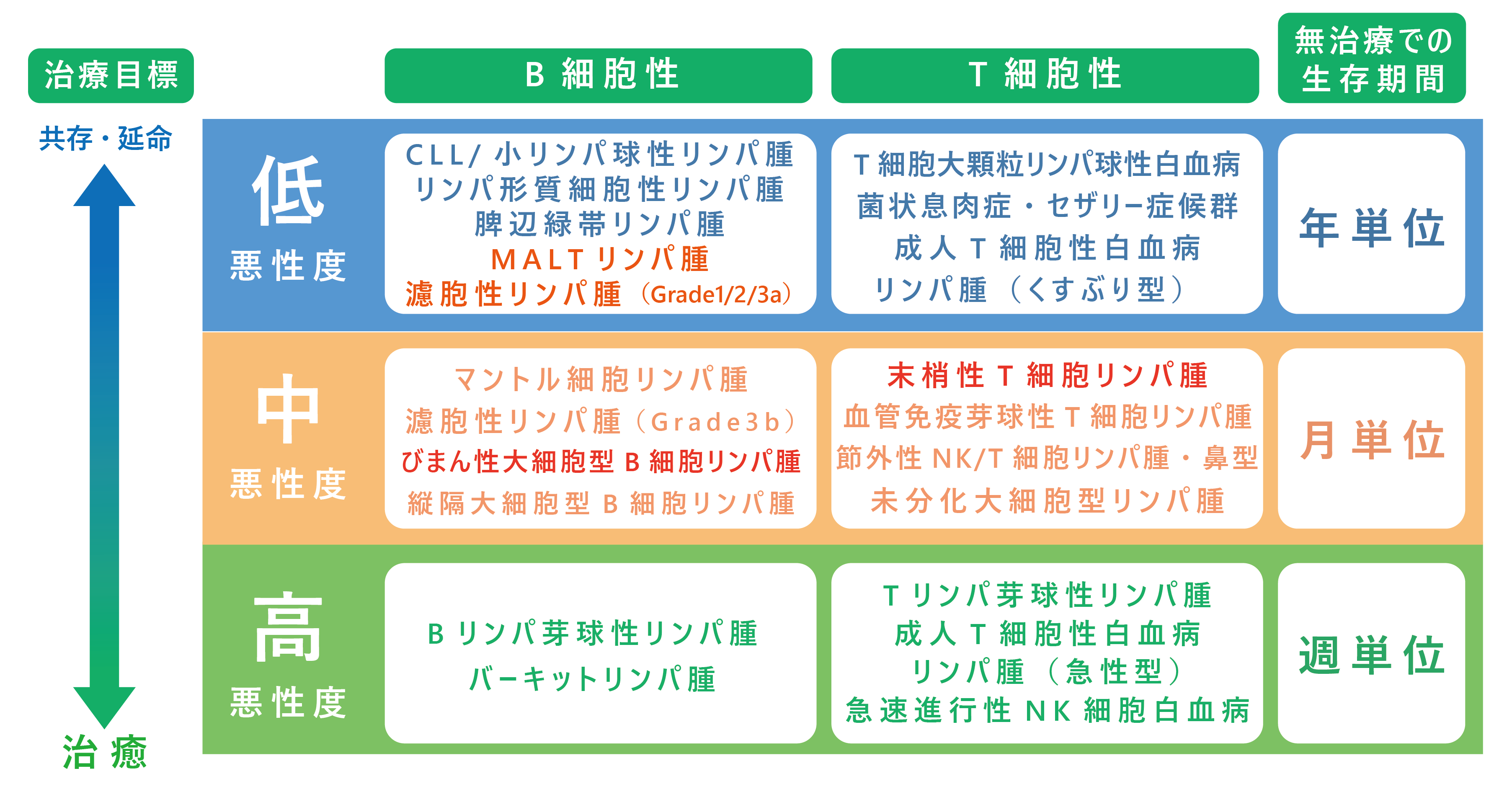
白血病と同様、悪性リンパ腫もWHO分類を用いた診断が行われており、現在100種類以上ものリンパ腫に分類されています。悪性リンパ腫は、大きく「ホジキンリンパ腫」と「非ホジキンリンパ腫」とに分けられます。日本人におけるホジキンリンパ腫の頻度は少なく、リンパ腫全体の5~10%程度です。また一般的ながんと同様、がん年齢(60歳前後)を越えて患者さんの数は増加しますが、20歳前後の若い患者さんも多く見られる特徴があります。現在、5種類のホジキンリンパ腫に分類されていますが、どのタイプも非常に「たちが良い」ことが特徴で、いずれのリンパ腫に対しても共通の治療が行われています。一方、日本人の大部分の悪性リンパ腫は非ホジキンリンパ腫ですが、進行のスピードやたちの良さ・悪さなどはさまざまです。通常、非ホジキンリンパ腫では、100種類近いリンパ腫を「悪性度」によって大きく3つに分け、それぞれの悪性度の特徴に応じた治療を行っています。日本人で最も多い「びまん性大細胞型B細胞リンパ腫」は「中悪性度」のリンパ腫であり、その次に多い「濾胞性リンパ腫」は「低悪性度」のリンパ腫です。
WHO分類
悪性リンパ腫の検査
悪性リンパ腫の診断において何より重要な検査は、リンパ節生検(腫瘍生検)です。腫れているリンパ節(腫瘍)の一部を手術で採取し、顕微鏡で観察します。また顕微鏡による形態の確認だけでなく、採取された組織の一部を用いて、リンパ腫細胞が持つ特徴的な蛋白質の種類(CD20抗原など)や染色体・遺伝子異常も調べることで、診断の確定を行います。さらに治療を行う上で重要となる検査は、病気の全身への広がり(病期分類)を調べる画像検査です。CTやMRI検査の他、最近ではPET検査が広く行われるようになっています。リンパ腫細胞が骨髄の中にまで広がっていると疑われる場合には骨髄検査を行い、脳や脊髄に広がっていると疑われる場合には髄液検査も行われます。
悪性リンパ腫治療の概要
悪性リンパ腫に対しては、薬物療法と放射線療法を中心に治療が行われています。リンパ腫の種類や病気の広がり、患者さんの年齢や状態などによって最適な治療法を決定します。
ホジキンリンパ腫に対する代表的な初回薬物療法は、「ABVD療法」です。病気の広がりを見て治療回数を決定しますが、放射線療法が併用されることもあります。
一方、非ホジキンリンパ腫においては、リンパ腫の悪性度によって、治療目標や治療内容は大きく異なります。
「低悪性度」に分類されるリンパ腫の進行は遅く、無症状のまま、無治療でも年単位で生きていくことが出来ます。ただし、治療による根治は期待出来ず、患者さんにとってどうしても治療が必要となった段階で最適な治療を行い、リンパ腫細胞の数を出来るだけ減らすことで、共存・長生きを目指します。通常、限られた場所にのみ病気の塊がある場合(限局期)には放射線療法が、病気が全身に広がっている場合(進行期)には薬物療法が行われています。さまざまな薬物療法があり、患者さんの状態に合わせて選択されています。
「中・高悪性度」に分類されるリンパ腫の進行は早く、数ヶ月で命を落とす可能性があります。しかし、低悪性度リンパ腫とは異なり、治療により根治が期待出来るという側面もあるため、中・高悪性度リンパ腫と診断された段階で、直ちに治療が行われます。「CHOP療法」は代表的な初回薬物療法ですが、リンパ腫細胞の表面にCD20という抗原(蛋白質)を持つB細胞性リンパ腫に対しては、リツキシマブなどの「抗体療法」も併用されます。リツキシマブは、CD20抗原を狙い撃ちにする人工的に造り出した抗体医薬です。
リンパ腫の種類によっては、特別な治療が行われているものもあります。例えば、「ヘリコバクター・ピロリ菌」に感染した限局期の「胃MALTリンパ腫」に対しては、ヘリコバクター・ピロリの除菌療法が行われています。また、「バーキットリンパ腫」に対しては「R-hyperCVAD/MA療法」が、限局期の「節外性NK/T細胞性リンパ腫・鼻型」に対しては「2/3DeVIC療法+放射線療法」が、進行期の場合には「SMILE療法」が行われています。
十分な治療効果が得られない、あるいは再発してしまった患者さんに対しては、初回とは異なる薬物療法(「救援化学療法」)が行われます。「ESHAP療法」や「GDP療法」などが代表的な薬物療法ですが、根治を目指す場合にはより強力な治療が選択されます。特に65才以下の患者さんでは、救援化学療法に続いて、「造血幹細胞移植」が行われています。白血病とは異なり、悪性リンパ腫に対しては通常「自家移植」が行われていますが、時に同種移植が行われることもあります。
悪性リンパ腫対しては、その他多くの「分子標的薬」(オビヌツズマブ、モガムリズマブ、ブレンツキシマブベドチン、イブルチニブ、ツシジノスタットなど)や「免疫調節薬」(レナリドミド)、「プロテアソーム阻害薬」(ボルテゾミブ)などが使用されています。
リンパ腫細胞に対するTリンパ球による免疫反応を強化した、「免疫療法」も行われています。十分な治療効果が得られないホジキンリンパ腫や縦隔大細胞型B細胞リンパ腫の患者さんに対しては、「免疫チェックポイント阻害薬」(ペムブロリズマブ)の投与が行われています。免疫チェックポイント阻害薬は、リンパ腫細胞に対するTリンパ球による免疫反応に掛けられたブレーキを取り除く薬剤です。エプコリタマブは、がん化したBリンパ球(B細胞性リンパ腫細胞)と患者さんの正常なTリンパ球とを繋ぎ合わせる抗体(「二重特異性抗体」)で、Tリンパ球がリンパ腫細胞を攻撃しやすくします。年齢を問わず、大細胞型B細胞リンパ腫のや濾胞性リンパ腫の患者さんに投与されます。「CAR-T療法」は、患者さんの体から正常なTリンパ球を取り出し、がん化したBリンパ球(B細胞性リンパ腫細胞)を攻撃しやすくする遺伝子を導入して再び患者さんの体に返し、遺伝子導入Tリンパ球(CAR-T細胞)がリンパ腫細胞を攻撃し死滅させることを期待する治療です。主に70才以下の、CD19陽性びまん性大細胞型B細胞リンパ腫の患者さんに対して行われています。
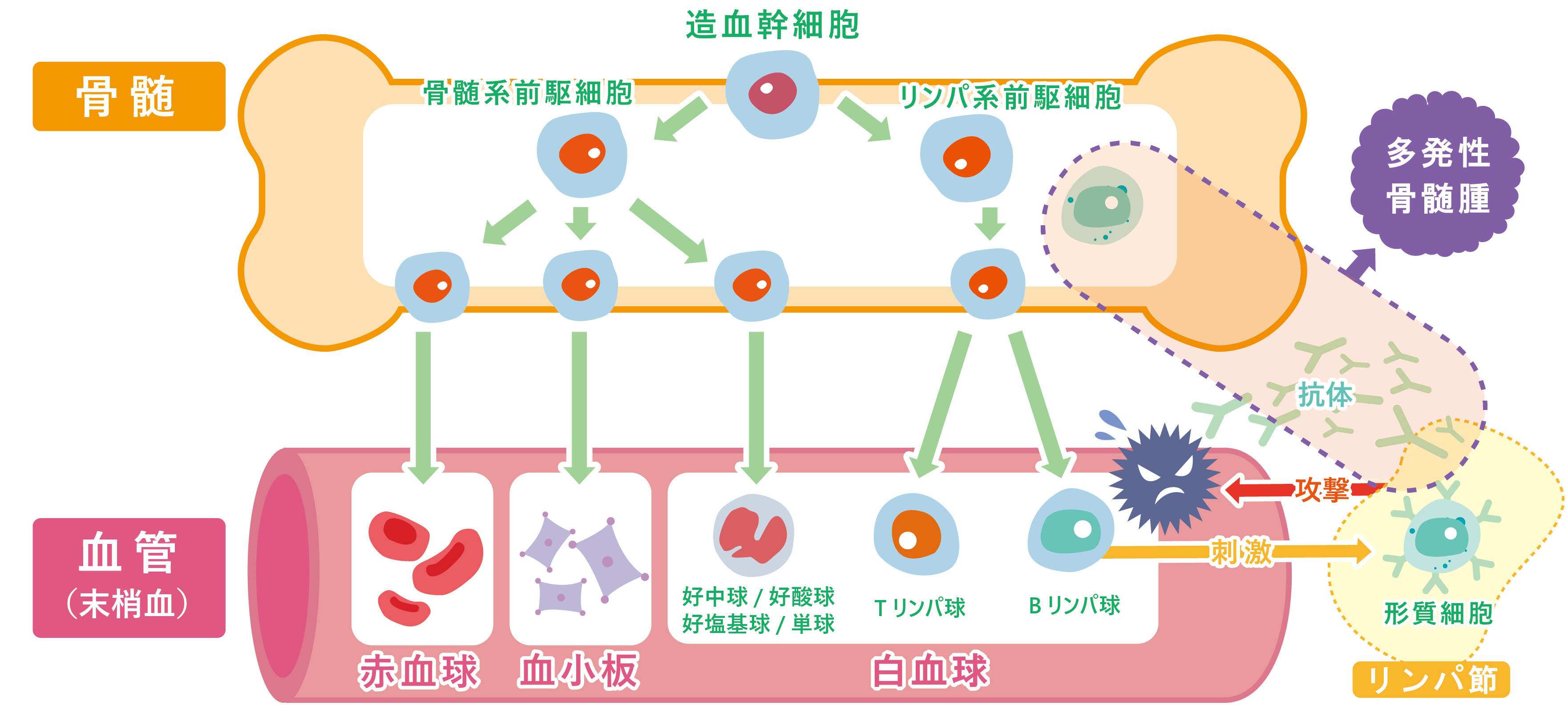
多発性骨髄腫について
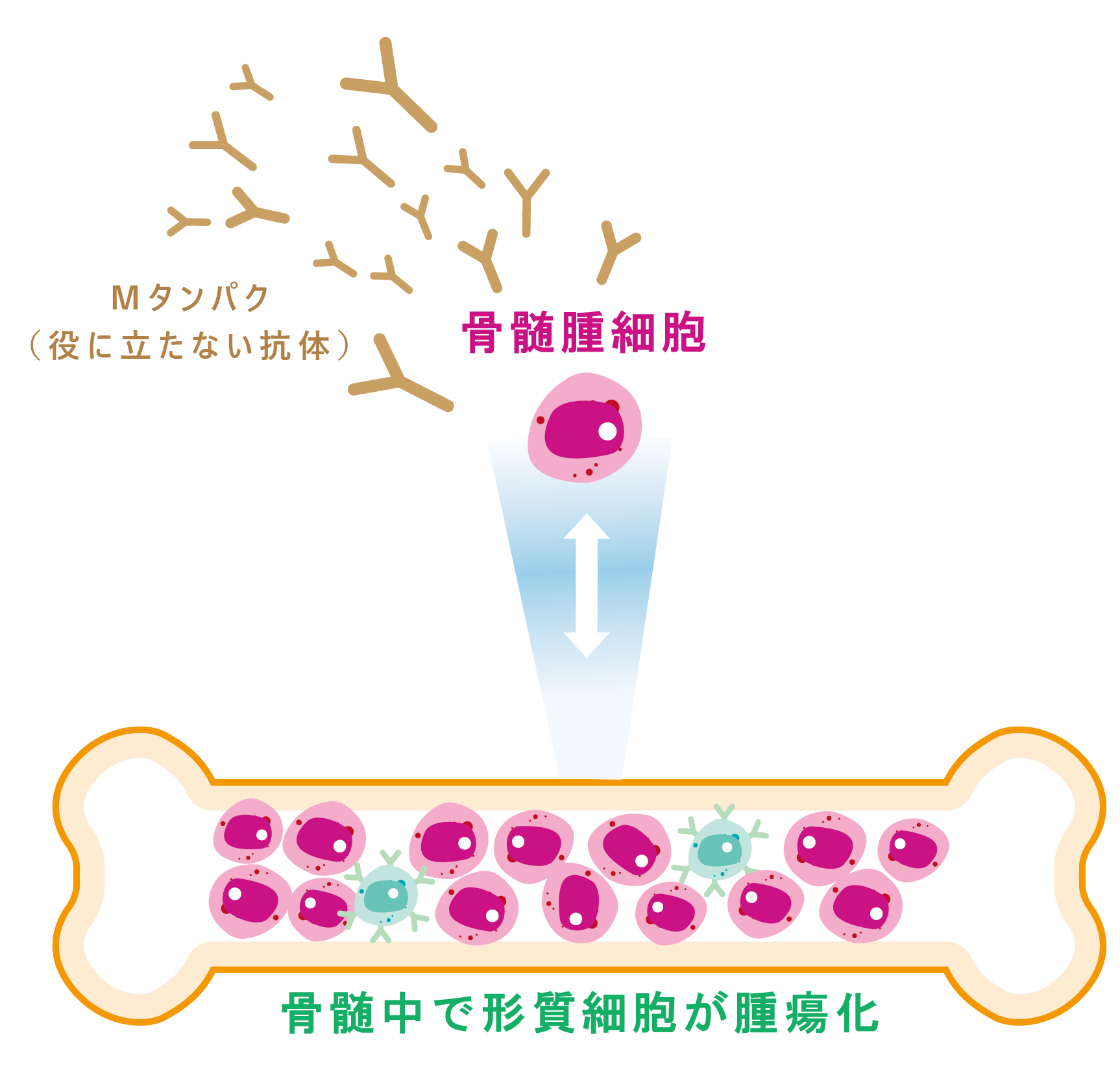
リンパ球の中の「Bリンパ球」と呼ばれる免疫細胞は、異物の刺激を受けながら、やがてその異物を攻撃する「抗体」を造り出す「形質細胞」へと成長していきます。この形質細胞は、一旦仕事を終えると骨髄の中に移動し、同じ異物が体に侵入してきた際に速やかに抗体を造り出せるよう待機しています。「多発性骨髄腫」は、この形質細胞が骨髄中でがん化して起こる病気です。形質細胞ががん化し「骨髄腫細胞」になると、骨髄腫細胞は骨髄の中で増殖するため、正常な血液を造る能力が低下します。また、「M蛋白」と呼ばれる攻撃能力のない抗体を作り続けるため、免疫力が低下するだけでなく、このM蛋白が血液や臓器の中へ蓄積されてくことで、全身にさまざまな症状を引き起こします。
多発性骨髄腫の症状
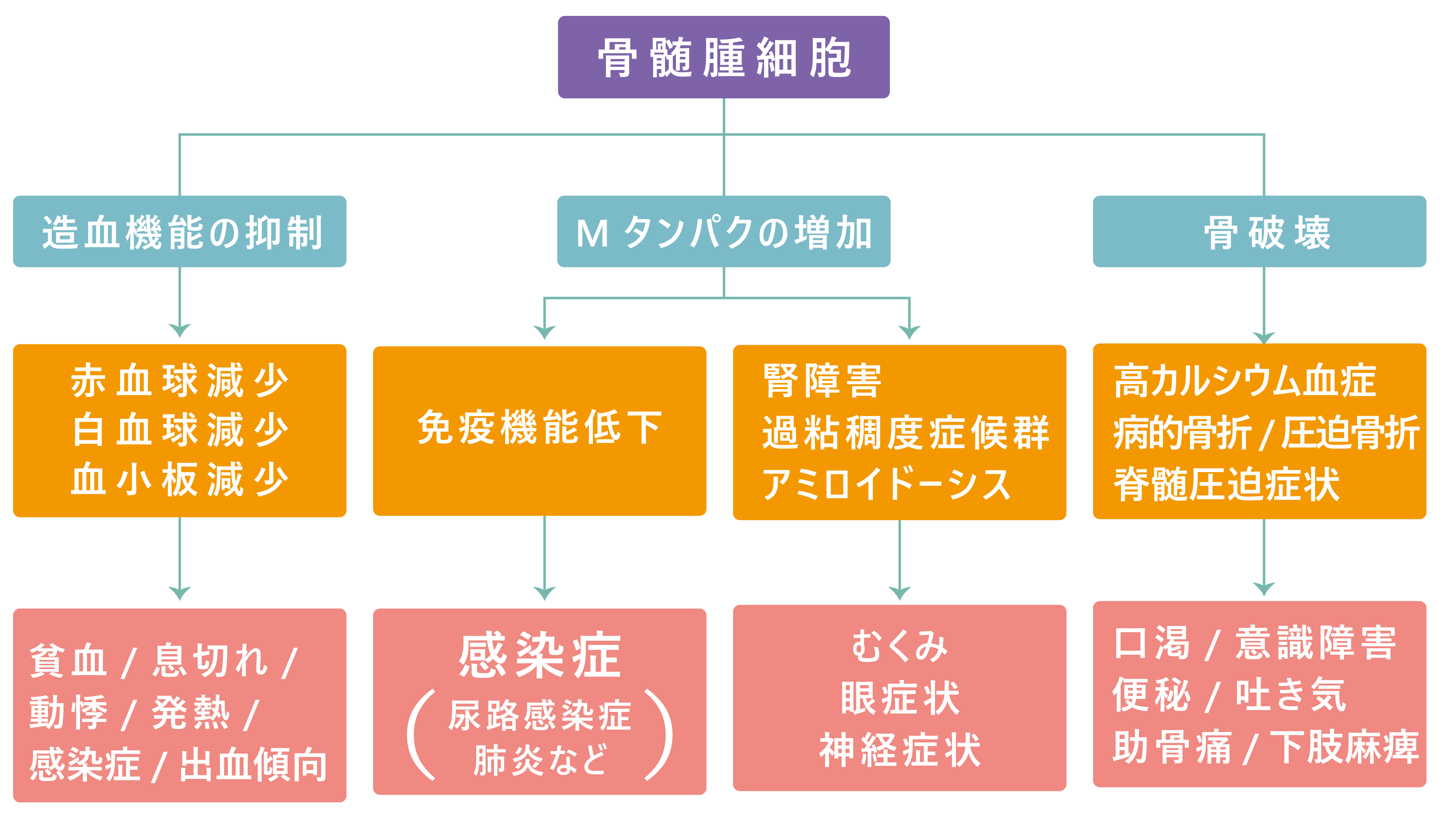
発病の初期にはほとんど自覚症状がなく、無症状でゆっくりと進行し、やがてさまざまな症状が出現します。骨髄腫細胞が骨髄中で増加することによって正常な血液細胞が作られなくなり、貧血や息切れ、動悸、倦怠感、発熱などの症状が現れます。M蛋白が増加すると、正常な抗体が減ってしまい、感染症にかかりやすくなります。また血液中でM蛋白が増加すると血液がどろどろになり(過粘稠症候群)、めまいや頭痛などの症状が現れます。M蛋白は体のあちこちの臓器にも貯まりやすい特徴がありますが(アミロイドーシス)、腎臓に貯まると腎障害を、心臓に貯まると不整脈を、神経に貯まると手や足のしびれや痛みを起こします。その他、骨髄腫細胞は、骨髄の中で周辺の骨を溶かしながら増えていきます。そのため、骨がもろくなって痛みや骨折を起こしたり、骨が溶けることで血液中のカルシウム濃度が高くなり、口の渇きや頭がぼーっとするなどの症状が現れます。
多発性骨髄腫の種類
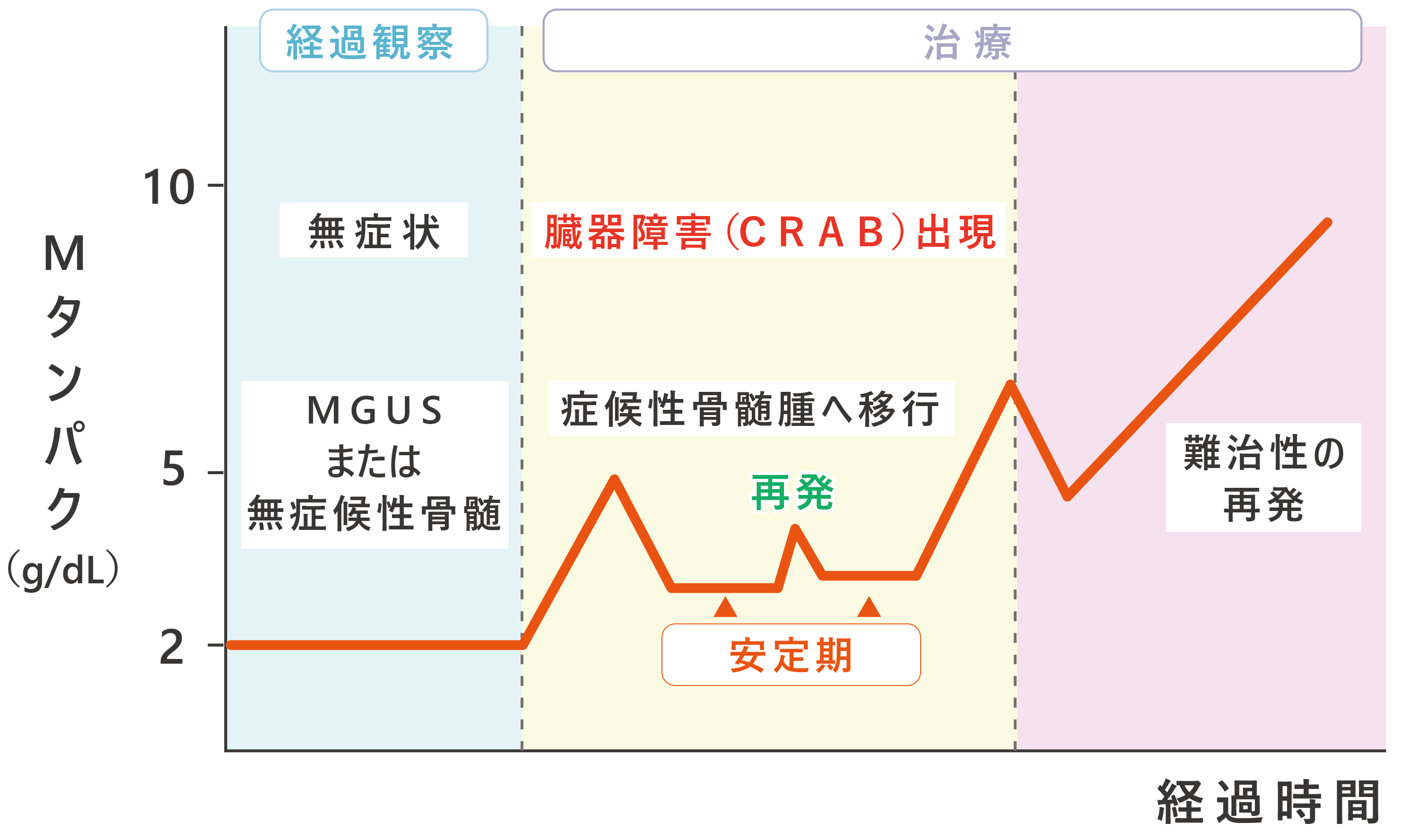
現在、多発性骨髄腫では、骨髄腫細胞の数やM蛋白の量、「CRAB」と呼ばれている臓器障害(高カルシウム血症、腎障害、貧血、骨の病変)の有無、骨髄腫細胞の塊が骨や骨以外の場所で出来ているかなどによって細かく分類された、IMWG(国際骨髄腫作業部会)による診断基準が広く用いられています。“いわゆる多発性骨髄腫”とは、臓器障害が見られるか、あるいは骨髄中に多くの骨髄腫細胞が認められ、病気が進行しているものをいいます。一方、骨髄腫細胞の数もM蛋白の量も極めて少なく、何ら症状のないものを「MGUS(意義不明の単クローン性免疫グロブリン血症)」と呼んでいます。多発性骨髄腫の「前がん病変」と考えられていますが、すべてのMGUS患者さんが多発性骨髄腫を発症するわけではなく、年1%程度の割合で多発性骨髄腫に移行すると言われています。
多発性骨髄腫の検査
多発性骨髄腫の診断や治療方針を決めるためには、血液・尿検査、骨髄検査のほか、骨のX線検査、CT、MRIなどの画像検査も行われます。骨髄検査では、骨髄腫細胞の有無や量を調べたり、たちの悪さを決める染色体・遺伝子異常の有無も確認します。これらの検査により、骨髄腫の種類や重症度(病気がどの程度進行しているか)を判定し、患者さんに合った治療内容を決定します。
多発性骨髄腫治療の概要
悪性リンパ腫と同様、多発性骨髄腫に対する治療も、薬物療法や放射線療法が中心となります。ただし、これらの治療で根治出来る病気ではなく、出来るだけ体から骨髄腫細胞の量を減らすことで、貧血や痛みなどの症状を和らげたり、少しでも長生きにつなげることを目指します。従って、何ら症状や臓器障害などが見られず、命の危険にさらされていない骨髄腫(無症候性骨髄腫)やMGUSの患者さんに対しては、通常治療は行わずに経過観察されます。
治療の強さは、年齢や患者さんの状態によっても異なります。おおむね65才以下で重い合併症のない患者さんに対しては、より骨髄腫細胞を減らして長生きにつなげるよう、強力な治療戦略が立てられます。具体的には、「プロテアソーム阻害薬」(ボルテゾミブ)や「免疫調節薬」(レナリドミド)などを併用した「薬物療法」を繰り返し行い、さらに骨髄腫にとどめを刺すような大量の「細胞傷害性抗がん薬」(メルファラン)を投与した後、骨髄での造血機能を回復させるため「造血幹細胞移植」を行います。ここで行われる造血幹細胞移植とは、「自家移植」です。一方、65才以上、あるいは重い合併症のある患者さんに対しては、命の危険がない程度にまで骨髄腫細胞が減った状態が維持出来るよう、プロテアソーム阻害薬や免疫調節薬の他、「抗体医薬」(ダラツムマブ)なども併用しながら、効果が見られる間は出来るだけ治療を継続します。
これらの治療により十分な効果が得られなければ、他のプロテアソーム阻害薬(カルフィルゾミブ、イキサゾミブ)や免疫調節薬(ポマリドミド、サリドマイド)、抗体医薬(イサツキシマブ、エロツズマブ)などの組み合わせによる薬物療法が行われます。
骨髄腫細胞が塊で増殖し(形質細胞腫)、その場所で痛みを起こしたり、脊髄を圧迫して麻痺症状などが出現する場合には、「放射線療法」が行われます。
また、骨髄腫による骨の病変の進行や痛み、高カルシウム血症を抑えることを目的に、「ビスホスホネート製剤」(ゾレドロン酸)や「高RANKLモノクローナル抗体」(デノスマブ)の投与が行われることもあります。
さらに、通常の治療では十分な効果が得られない骨髄腫患者さんに対しては、「免疫療法」も行われています。エルラナタマブは、骨髄腫細胞と患者さんの正常なTリンパ球とを繋ぎ合わせる抗体(「二重特異性抗体」)で、Tリンパ球が骨髄腫細胞を攻撃しやすくします。年齢を問わず、全ての骨髄腫患者さんに投与されます。「CAR-T療法」は、患者さんの体から正常なTリンパ球を取り出し、骨髄腫細胞を攻撃しやすくする遺伝子を導入して再び患者さんの体に返し、遺伝子導入Tリンパ球(CAR-T細胞)が骨髄腫細胞を攻撃し死滅させることを期待する治療です。主に70才以下の骨髄腫患者さんに対して行われています。
スタッフ

専門分野
血液内科
腫瘍内科
造血幹細胞移植
学会専門医・認定医
日本内科学会認定内科医・指導医
日本内科学会近畿支部評議員
日本血液学会血液専門医・指導医
日本血液学会評議員
近畿血液学地方会評議員
日本臨床腫瘍学会がん薬物療法専門医・指導医
日本臨床腫瘍学会協議員
日本がん治療認定医機構がん治療認定医・指導責任者
日本造血細胞移植学会造血細胞移植認定医
日本輸血・細胞治療学会認定医
日本輸血・細胞治療学会認定細胞治療認定管理師
日本自己血輸血学会認定自己血輸血責任医師
公益財団法人骨髄移植推進財団調整医師
日本メディカルAI学会公認資格 機械学習・深層学習基礎コース/メディカルAI専門コース
JDLA DeepLearning for GENERAL 2017
JDLA Generative AI Test 2023
厚生労働省認定臨床研修指導医
神戸大学客員准教授
医学博士
関連するニュース記事
- 2025.12.09患者さん向け
- 2025.12.01患者さん向け
- 2025.12.01患者さん向け
- 2025.11.10患者さん向け






